3年24日,美国食品和药物管理局官方网站显示,吉利科学公司正在开发的新型抗病毒药物瑞奇威被授予冠状病毒病孤儿药资格。什么是
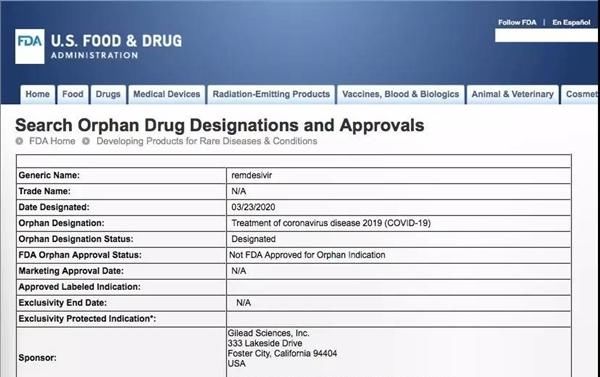
孤儿药?
孤儿药是指一些专门用于治疗或控制罕见疾病的药物。
罕见疾病是指患者人数占总人口0.65‰-1‰的疾病。

然而,世界各国根据本国国情在鉴别罕见疾病的标准上有所不同。例如,美国定义一种病人少于20万的疾病。欧洲被定义为发病率低于1/2000的疾病。
我国对罕见疾病没有明确的定义,但普遍的共识是,成人患病率低于1/500,000,新生儿发病率低于1/10,000的疾病可以定义为罕见疾病。
此外,由于罕见疾病患者数量少,新药研发成本高,为了考虑利润和投资回报,制药研发公司往往不愿意在罕见疾病的研发上投入巨额资金。
为了鼓励针对罕见疾病的药物,美国食品和药物管理局从1983年开始为孤儿疾病的研究项目提供绿色通道,加快了批准程序。
值得注意的是,根据1983年发布的《孤儿药物法》,美国食品和药物管理局为开发“罕见疾病”疗法的制药公司提供7年的市场垄断期,这种保护不受专利的影响。
在此期间,该药物只能由原研发企业独家生产和销售。美国食品和药物管理局将不再批准其他具有相同适应症的药物上市,仿制药的申请也将被禁止。此外,
还将提供税收优惠政策、专项研发资金支持、快速评估政策、新药申请费减免、药物研究和实验设计援助等。
,也就是说,瑞奇威这次获得了美国食品和药物管理局的孤儿药认证,这意味着吉利将有权独家保护瑞奇威,7年的市场垄断期进一步阻止了其他仿制药制造商提供反仿制药。
应当强调的是,孤儿药的鉴定并不意味着它们被批准上市,并且药物的上市仍然必须通过临床试验数据来验证其治疗效果和药物安全性。拉迪卡病毒
最初用于预防和治疗埃博拉病毒感染,但效果不明显,人们对此寄予厚望。
早在2015年,美国食品和药物管理局就已经对用于埃博拉病毒适应症的雷扎韦孤儿药进行了鉴定,但由于雷扎韦治疗埃博拉病毒的三期临床试验失败,该药未能获准上市。在
新型冠状病毒肺炎爆发后,研究人员发现动物模型已经证明该药物具有体外和体内抗具有类似结构的冠状病毒如MERS和非典的活性,因此对新型冠状病毒的治疗也寄予厚望。
1年21日,中国科学院武汉病毒学研究所申请了中国发明专利,使用ridgeway对抗新的冠状病毒。这一“先发制人登记”的行为引起了广泛的争议。
2年1月1日,《新英格兰医学杂志》在一个简短的报道栏中报道了美国首例新型冠状病毒成功治愈的确诊病例。
根据文章,新型冠状病毒感染者经隔离治疗后病情恶化,使用拉德克利夫后效果立即显现

Ridgeway当时在美国未被批准,医生根据“同情用药”的原则在治疗第一个确诊患者时使用了它,但效果并不明显。
2年3月,拉德塞维利亚在中国匆忙开展了第三期临床研究。两组试验都是随机的“双盲试验”,试验结果预计在4月初公布。
2年2月5日下午,科技部在武汉金印滩医院召开了“2019年新型冠状病毒感染的拉德克利夫治疗研究”应急研究项目的启动会议。相关专家在启动会上表示,第一批感染新型冠状病毒的肺炎患者将于2月6日开始服药。
目前,包括韩国、日本、法国等9个国家。已开始瑞奇威治疗新发肺炎的临床试验。然而,值得注意的是,尽管里奇韦公司在对付冠状病毒方面显示出了希望,但并不能保证它能通过临床试验。
回顾2003年特定药物的审批流程,我们可以看到中国第一个治疗非典的特定药物——人抗非典特异性免疫球蛋白于2003年7月28日发布,但在2004年8月9日被批准紧急使用。
也许正如紫藤知识产权集团的高级知识产权顾问和项目总监赵有斌所说:
Ridgeway,即使它有孤儿药的地位,也只能加速临床试验各方面的审批,在最终上市前仍需要经过严格的临床试验过程。

来源:雷锋网