照片来源@全景视觉
钛媒注:本文来源于微信公众8号健康洞察,作者:吴毛,编辑:王,钛媒授权出版
昨天(1月7日)晚,国家食品药品监督管理局(NMPA)发布了2020年第1号文件《支持药物研发和评价的真实世界证据指南(试行)》
行业和学术界对此评价很高。中山大学药学院药物经济学研究所所长宣建伟说:“这是一个里程碑式的事件,因为这是监管理念的一个重大转变。”。
199上海健康与健康发展研究中心主任金春林也指出,“现实世界研究/学习(RWR/RWS)已经适应了当前科学发展的方向。”零氪科技联合创始人兼首席运营官罗立刚表示:“”现实世界研究将是药物研发的一个重要方向。早在去年五月,当草案发布时,它就已经在制药业引起了巨大的震动。新药研发耗时长,成本高,给患者带来沉重负担。这是一个世界性的问题。在降低药物研发成本方面,“现实世界的研究可以说是为数不多的创新方向之一。”“
制药公司非常欢迎真实世界证据(RWE)。一家跨国制药公司的经理认为,“以前许多药物都是通过真实世界的数据获得新适应症的批准”,“我们会考虑真实世界的数据,而以前确实没有办法。有了政策后,我们会更方便或更早地讨论使用真实世界的证据。"
真实世界研究是一种与随机对照试验(RCT)相对应的循证医学研究方法
简而言之,RWS从真实世界数据(RWD)中挖掘除传统循证临床研究之外的信息,采用非随机、开放、无安慰剂的研究,并通过分析获得真实世界的证据以支持医疗产品监管决策
|美国在1992-016年12月通过的《21世纪康复法案》通常被视为现实世界证据的起点,以支持对药物和其他医疗产品的监管决策,并加速医疗产品的研发此后,RWS成为全球相关监管机构、制药行业和学术界共同关注的一个具有挑战性的问题国家食品药品监督管理局发布《指导原则》仅比美国晚三年。中国在新药审批方面的创新正在加速。获得
种罕见疾病药物、批准广谱药物的新适应症(如PD-1抑制剂)和重新评价中药被认为是可尽快受益于《指导原则》的方向。
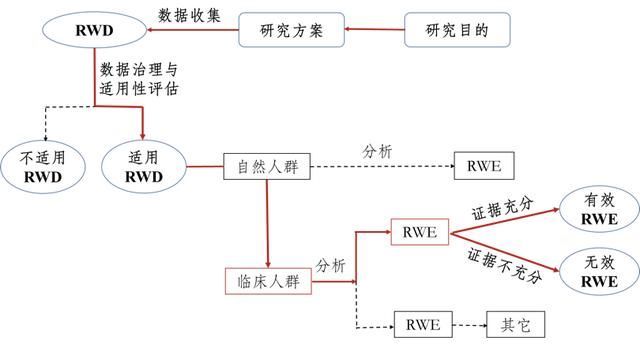
△支持药物监管决策的现实世界研究路径(实线所示)资料来源:《支持药物研究和评价的真实世界证据指导原则(试行)》
“指导原则”为支持药物监管决策的真实世界证据提供了五个应用领域,其中第五个是其他领域,前四个非常具体:
(1)为新药注册和上市提供了有效性和安全性的证据;
(2)为上市药品的说明书变更提供证据;
(3)提供上市后要求或药物再评价的证据;
(4)中医老中医经验方、人类经验总结及中医医疗机构制剂的临床研发
对于第1项,患有罕见疾病的患者被认为是最有可能受益的群体。
世界上已知的罕见疾病约有7000种,其中只有约6%能用药物治疗。世界正在加速稀有疾病药物的研究和批准。
中国约有2000万罕见患者2018年5月,国家发布了第一份罕见疾病目录,其中包括121种罕见疾病,影响了约300万患者。截至2018年12月,其中74家在美国、欧盟、日本等地拥有162种治疗药物其中只有83种在中国上市,可以治疗53种罕见疾病。2019年,NMPA批准了8种新的罕见疾病药物,用于治疗8种罕见疾病,其中6种被列入第一批罕见疾病名单
每种罕见疾病药物几乎代表了一个群体的生存希望文健几天前的一篇文章“国家健康保险局已经对罕见疾病的提议做出了强烈回应,并将继续把孤儿药纳入下一步的健康保险”留下了一条信息。许多类型的罕见病人都在呼吁新药。
但国外批准的罕见疾病药物有一半没有进入中国,重要原因是临床试验难以完成。传统的临床试验需要一个实验组和一个对照组。罕见的病人已经非常罕见了。招募足够多的患者加入这一群体已经成为最大的挑战。但是,如果用真实世界的数据来显示疾病的自然特征,并与实验组进行比较,可以少招募一半的患者,这无疑将大大降低制药公司的成本,并加快中国罕见疾病新药的注册和上市。
此外,对于适应症非常广泛的药物,如PD-1抑制剂,通常在新药上市后会出现许多过度适应症的情况。现实世界的研究是一个非常好的方法,可以迅速扩大更多的适应症。有
种药物通过真实世界数据获得新适应症批准的先例。《指导原则》公布了贝伐单抗的案例
贝伐单抗是一种针对血管内皮生长因子的人源化单克隆抗体制剂。2015年,中国批准联合化疗(卡铂和紫杉醇)用于不能切除的晚期、转移性或复发性非鳞状非小细胞肺癌患者的一线治疗。
2年10月和2018年,国家食品药品监督管理局将贝伐单抗的适应症从“联合卡铂和紫杉醇的化疗”扩大到“联合铂的化疗(包括顺铂、卡铂+培美曲塞、吉西他滨、白蛋白、紫杉醇、长春瑞滨和其他常用药物)”
背后的证据来自山东省肿瘤医院、江苏省肿瘤医院和中国医学科学院肿瘤医院的真实数据以山东肿瘤医院为例,在一项对1352名患者进行的真实世界回顾性研究中,接受贝伐单抗加一线化疗的患者的中位总生存期比仅接受化疗的患者长3个月,且不良反应可耐受。
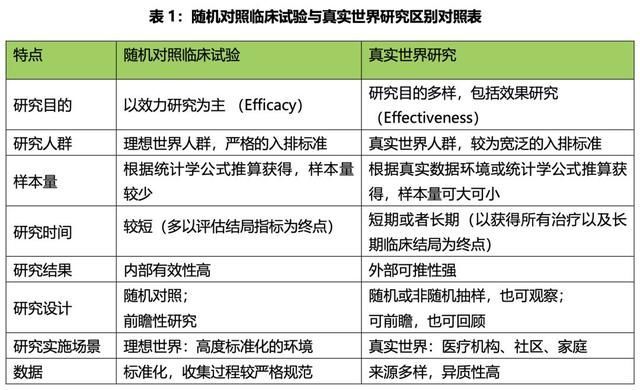
△来源:2018年版《真实世界研究指南》(由吴阶平医学基金会肿瘤学系主任吴一龙等相关专家撰写)
《真实世界证据》,对药物研发最直接的价值是降低成本
新药开发时间长,成本高,成功率低。许多年前,有一种说法是,一种新药平均10年研发一次,花费10亿美元。近年来,这一成本仍在上升。前美国食品和药物管理局
审批官员、国家药物评价中心(CDE)首席科学家何如一曾指出,目前药物研发成本居高不下的趋势是不可持续的,必须采用新方法来降低药物研发成本。一种方法是使用真实世界的数据来支持评估,这可以部分取代目前药物研发中的临床试验,并节省药物研发成本。
也是制药公司欢迎真实证据的原因之一。上述跨国制药公司的经理表示,RWE可以在一定程度上降低新药研发的三期临床试验成本。对于适应症扩大的药物,可直接免除第3阶段临床试验
“对于符合RWE要求的企业,其成本和时间将大幅降低,特别是对于广谱药物的推广适应症,使用RWE是非常好的”,但罗立刚认为,RCT也将成为新药营销的主流,而RWE将起到辅助和补充的作用
“在政策开始时,如果制药公司能负担得起RCT,他们可能仍会优先考虑RCT。毕竟,RWE是一个新事物,需要进一步验证。”罗立刚甚至断言,“政策实施后,许多企业会尝试发起RWE研究,但最终他们能够跑下来,真正得到有效可靠的证据,不会太多。”“
断言这是因为现实世界的数据(RWD)基础作为RWE的前提是不够的
真实世界的研究,其中一些是前瞻性的,另一些是回顾性的,基于注册批准的历史数据。基于历史数据的研究并不完全取决于企业本身是否有能力,更重要的是,当前数据的可用性以及它们的质量是否能够满足注册的需要。
过去,医疗系统中的数据不是用于登记,而是主要用于监管。例如,医疗保险制度主要是为了满足医疗保险作为支付监督的任务。然而,现实世界的研究需要关于注册申请、评估效果、产品有效性和安全性的数据。原始系统的数据丰富性是不够的。
昨天,当看到新发布的《指导原则》时,令罗立刚惊讶的是,其中很大一部分提出了真实世界数据的表达,包括数据相关性和可靠性的评价,以及统计方法和研究方法的介绍。“这表明监管当局在制定政策方面非常成功“
如果《指导原则》的颁布为现实世界证据的应用建立了规范,那么将需要更详细的规则和标准来顺利实施以下政策。根据罗立刚的理解,现实世界数据的详细指南也正在讨论和推进,“具体说明什么样的现实世界数据可以获得现实世界的证据,然后扩展这些迹象。”
金春林还认为,随着政策的落地,肯定会有更为详细的“游戏规则”,而规则的制定不仅需要CDE牵头,还需要CDE调动专家网络的力量共同开发,包括研究医院和国家研究中心等。应该一起参与。
去年9月,互联网上有一个短片来自河南许昌市的8岁女孩潇雅跑到药店,说她会买伟哥。她买了十盒伟哥,每盒500元近年来,有些尴尬的场面不断上演。面对别人奇怪的眼神,萧雅的母亲只能一遍又一遍地流泪解释——她的女儿是肺动脉高压患者,服用伟哥可以挽救她的生命。
潇雅患特发性肺动脉高压是“第一批罕见疾病”之一。这类病人很年轻,但他们的生活质量却极低。一旦确诊,他们的平均寿命不到三年,他们的外表很健康,但他们的活动能力有限。日常行走对他们来说也是一种痛苦的折磨。
有十几种治疗肺动脉高压的药物,而未经批准的伟哥是最便宜的。例如,视频中的潇雅每月花费约3000元,而其他药物的价格为6000-30000元。
爱西克罕见病护理中心对会员患者进行的调查发现,在中国,50.8%的肺动脉高压患者使用“伟哥”药物治疗。西地那非被列为“2018年中国肺动脉高压诊疗指南”的一线治疗药物
中国工程院院士钟南山等人希望将西地那非纳入医疗保险,但没有适应症,肺动脉高压患者不能受益。
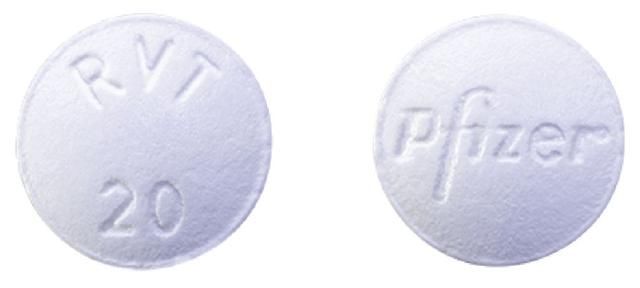
△白色“伟哥”是一种治疗肺动脉高压的药物
2005,美国食品和药物管理局已批准使用西地那非(商品名为Revatio,伟哥的颜色和剂量不同)治疗成人肺动脉高压(不包括17岁以下的儿童)。然而,在中国,由于肺动脉高压发病率低、临床试验投资大以及预期利润不确定,制药公司几乎没有动力申请增加适应症。
现实世界研究是解决这一困境的希望。特发性肺动脉高压患者对西非新适应症(伟哥药物)的期望已将第一和第二应用领域纳入《指导原则》。随着新政策的出台,服用伟哥的小女孩会成为最早的受益者之一吗?