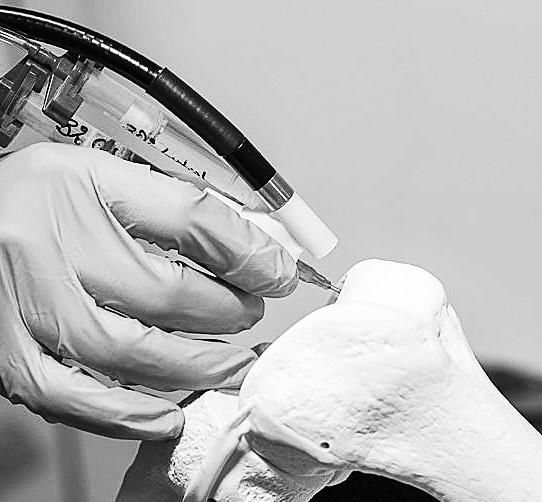
为满足临床实践中罕见的特殊个性化需求,规范定制医疗器械的监督管理,确保定制医疗器械的安全性和有效性,国家食品药品监督管理局和国家卫生安全委员会近日联合发布了《定制医疗器械监督管理条例》,将于2020年1月1日起施行《条例》分为六章三十五条,包括总则、备案管理、设计加工、使用管理、监督管理和补充规定,从定义、备案、设计、加工、使用、监督管理等方面明确了定制医疗器械的要求。
定制医疗器械是指在我国上市产品不能满足临床需求的情况下,医疗器械制造商根据医疗机构的特殊临床需求,为满足指定患者的罕见和特殊疾病及损伤,提高诊疗效果而设计和生产的个性化医疗器械。考虑到定制医疗器械仅用于特定患者,且数量很少,目前的注册管理模式很难注册,条例明确对定制医疗器械实施备案管理,定制医疗器械生产企业和医疗机构共同作为备案人。定制医疗器械生产和使用前,应当向医疗器械生产企业所在地省级药品监督管理部门备案。为合理控制风险,该规定对生产和使用定制医疗器械的制造商和医疗机构提出了明确要求,并规定定制医疗器械不得委托生产。
《规定》还强调,定制医疗器械的开发和生产不仅要满足医疗器械生产质量管理标准和相关附录的要求,还要满足特殊要求,包括医务人员的互动人员、设计和开发、质量控制和可追溯性管理的要求定制医疗器械的手动标签应反映定制的特点,并可追溯到特定患者。为加强上市后监管,定制医疗器械的生产和使用实行年度报告制度。对于定制医疗设备的使用、广告和患者信息保护也有相应的要求。
《条例》还规定,当定制医疗器械的临床病例和初步研究数量能够满足上市前审批要求时,应按照《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》的规定进行注册申报或备案符合伦理标准且真实、准确、完整和可追溯的临床使用数据可用作注册申请的临床评估数据。例如,金属3D打印定制颈椎融合体经过一定数量的临床应用,产品基本定型后,可以作为患者申请注册的配套医疗器械。
还规定,匹配医疗器械的患者、符合《医疗器械紧急审批程序》相关规定的医疗器械以及含有药物成分或生物活性成分(如细胞和组织)的定制医疗器械不适用本条例