
经过一个寒冷的冬天,三年前由于“魏则西事件”而跌入谷底的细胞免疫疗法正迎来资本的涌入。
今年以来,截至9月20日,国内细胞免疫治疗行业融资金额接近22亿元,超过去年全年,是2016年的5倍多,是2017年的近17倍,表现出较高的资金热情。
此外,本月初,获得中国第一个IND批准、目前唯一获准进入实体瘤治疗二期临床试验的细胞免疫治疗产品永泰生物,计划在香港上市,给企业和投资机构带来了希望。
投资者认为,随着两种CAR-T产品在国外上市的批准和国内政策监管的逐步规范化,细胞免疫疗法将迎来新的发展机遇。但是细胞免疫疗法会在冬天之后迎来春天吗?
资本热情高涨风险投资成为第一大主力目前,美国和中国是开发细胞免疫治疗产品最活跃的两个国家根据美国专业杂志《自然评论药物发现》今年5月发布的一份报告,美国和中国分别有400多种和300多种已批准和正在开发的细胞免疫治疗产品,约占总数的四分之三。
该报告还指出,目前中国47%的细胞免疫疗法是由生物技术公司开发的,比去年的38%有显著增长,中国的细胞免疫疗法行业已经基本形成了生物企业和科研机构平分秋色的局面。这反映了中国细胞免疫治疗行业的快速发展,当然,这离不开资本的帮助。
根据CVSources投资数据,自2018年以来,资本迅速涌入细胞免疫疗法行业。2018年,融资事件总数达到22起,创历史新高,涉及金额约21.07亿元,较2017年披露金额大幅增长15倍以上。截至今年9月20日,虽然仅发生15起融资事件,但融资金额已接近21.66亿元,比去年增长5.33倍,分别比2016年和2017年增长16.53倍。
细胞免疫治疗在2017年遭遇了资本冬天,这在很大程度上受到了“魏则西事件”的影响2016年4月,魏泽西在接受所谓的免疫治疗后因病情恶化而死亡,引起了社会关注,刚刚略有好转的行业融资立即陷入寒冬。直到2017年底,资本才重获兴趣,融资活动的数量和金额在2018年初达到新高。
根据融资进度,过去10年进入细胞免疫治疗行业的资金集中在A轮,25轮融资金额达到17.11亿元,其次是B轮和C轮,分别为11.72亿元和831亿元。虽然有24轮天使轮,仅次于a轮,但融资总额只有3.2亿元。这也间接地表明细胞疗法行业仍处于发展的早期阶段。除了严冬之外,还与企业成立时间相对较短有关,企业大多位于2013年以后。
那么,哪个资本对细胞免疫疗法行业最感兴趣?据统计,近十年来,风险投资和私募股权投资已成为两大主要投资来源,其中风险投资占103例,投资额最高的为103.53亿元,私募股权投资占86例,其次为78.40亿元。淡马锡、红杉中国、软银中国资本、礼来亚洲基金、CDH投资、骏利资本、深证创投等一批知名机构纷纷进入市场。然而,这些机构很少在多个回合中相互跟随。为什么在过去的两年里,
资本对细胞免疫治疗行业表现出更大的兴趣?歌特佳投资集团创始人兼董事长蔡大建表示,中国汽车T系列产品的相继获批和CFDA电池产品相关政策的出台,意味着该行业真正迎来了一个新时代。高特佳去年参与了上海斯达兹生物技术有限公司1.8亿元的b轮融资。该公司成立于2009年,主要从事细胞治疗、干细胞和基因编辑等领域。
此外,企业也是不可忽视的投资力量。同期投资事件总数达到33起,总投资规模45.81亿元。值得注意的是,近年来,姚明康德、中原谢赫、安科生物、瑶姬科技等众多上市公司也纷纷进入a股市场。一度,由近20家上市公司组成的细胞免疫治疗概念股在a股市场形成。
与风险投资、私募股权投资等投资机构的不同之处在于,企业在进入细胞免疫治疗行业时,仍有完善公司业务布局的意图。此前曾斥资1.75亿元参与上海细胞疗法集团有限公司三轮融资的姚记科技表示,公司继续重视公司的发展前景,同时投资也有利于改善公司产业链的结构和布局。
第四种抗癌疗法的前景有利也有弊。有趣的是,2017年,当国内资本处于低潮时,该行业通常认为这是细胞免疫疗法的第一年。
年8月和10月,诺华制药和凯特制药的两种CAR-T产品被美国食品和药物管理局批准上市,这意味着细胞免疫疗法是商业化的第一年。这也使得全球对细胞免疫疗法的热情迅速上升。其研发管道的规模已经超过了肿瘤免疫治疗的整个领域。免疫疗法甚至被认为是继放疗、化疗、手术和靶向治疗之后的第四种抗癌方法。
根据《自然评论药物发现》的报告,截至今年3月,全球已有1011项细胞免疫疗法获得批准或正在开发中,比去年同期增加了258项。其中,卡丁车疗法占50%以上,共有568款,截至2018年3月,增加了164款,体现了行业对卡丁车疗法的巨大热情。
除了第一、第二批CAR-T产品上市,2017年美国制药巨头吉利科技以119亿美元现金收购了凯特制药,复星制药与凯特制药、获得国内首个CAR-T临床批准的南京联想、美国强生公司等联手。,都显示了行业对细胞免疫疗法的偏好。
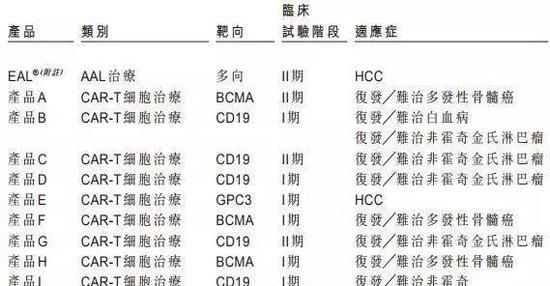
根据永泰生物招股书数据,截至今年8月,我国临床使用的细胞免疫治疗产品有10种,其中3种处于临床ⅱ期,目前还没有细胞免疫治疗产品上市或提交给NDA。值得一提的是,今年8月,世界上第一个CAR-T产品——凯姆瑞亚的临床应用被药品检验中心接受。
细胞免疫疗法的流行背后是未来的市场空间众所周知,癌症已经成为世界第二大死亡原因,也是中国最大的杀手。根据世卫组织的报告,预计2018年全球新增癌症病例为1810万,癌症死亡人数为960万。其中,中国癌症发病率和死亡率居世界首位。2018年,中国癌症新发病例和死亡人数分别占全球的21%和24%,中国癌症治愈率远低于美国等发达国家。
这些将为癌症免疫治疗的未来发展提供基础。正如巴黎第六大学的免疫学家大卫·克拉赞曼曾公开说过的:“细胞免疫疗法是一个极其疯狂的领域,竞争激烈,前景广阔。”“
根据乔斯特·沙利文的报告,全球癌症免疫治疗市场将从2018年的206亿美元增长到2023年的755亿美元,中国将从19亿元增长到824亿元。其中,从2021年到2023年,中国细胞免疫治疗市场的规模预计将从13亿元增长到102亿元。随着更多细胞免疫治疗产品获得批准,2030年将达到584亿元,即从2021年到2030年复合年增长率接近53%,快速增长。
细胞免疫疗法是癌症免疫疗法的主要类型之一。一般来说,其治疗机制是通过技术手段安装“全球定位系统”后,从患者血液或肿瘤组织中提取免疫细胞,并将其注射回患者体内,从而对肿瘤细胞形成局部打击国内外对
的许多研究表明,免疫疗法可以提供相对持久和较高的缓解,在预防肿瘤复发方面具有显著优势,从而延长患者的生存时间。同时,免疫疗法对某些晚期癌症患者通常具有良好的安全性和有效性,可以避免传统放疗、化疗、手术等方法的弊端。2013年,癌症免疫疗法被《科学》杂志列为年度十大科学突破。两位美国和日本的免疫学家也因为他们在肿瘤免疫领域的贡献获得了2018年诺贝尔生理学或医学奖,所有这些都显示了免疫疗法在该行业的认可。
此外,增强抗肿瘤免疫的联合疗法已成为整个癌症界非常感兴趣的领域,但迄今尚未取得突破。永泰生物在招股说明书中引用了乔斯特·沙利文的报告,称预计中国的细胞免疫治疗研究将进一步多元化。除了探索更多的适应症,免疫疗法和其他疗法的结合也将是一个主要趋势。研究表明,联合治疗比单一常规治疗能带来更好的临床效果。
然而,细胞免疫疗法仍然面临许多挑战和限制首先,必须注意的是,尽管细胞免疫疗法对某些肿瘤类型有显著效果,但也有一个B平面目前,最流行的抗逆转录病毒疗法挽救了急性淋巴细胞白血病患者艾米丽·怀特黑德的生命,但它也有毒副作用,如细胞因子风暴、神经毒性和B细胞缺失。由于细胞免疫疗法在临床实践中仍未得到广泛应用,临床试验面临患者数量的限制,一些肿瘤,尤其是实体瘤的有效性和安全性难以充分验证,国内公众认识不足。
一位来自3A医院的专家说,尽管免疫疗法在中国相对较热,但通常只有在传统方法不能有效治疗后,患者才有可能尝试它。近年来的“魏则西事件”和几起相关死亡事件,在一定程度上暴露了细胞免疫治疗在临床应用和实验阶段的安全性问题。
其次,细胞免疫疗法不是“万灵药”根据上面提到的专家,细胞免疫疗法的适应症是有限的,并且在国内外许多实体瘤类型中没有进行过试验。然而,数据显示实体瘤占所有癌症病例的90%以上,这意味着细胞免疫疗法在核心实体瘤领域中发挥有限的作用。
永泰生物也在招股说明书中表示,CAR-T疗法在白血病、非霍奇金淋巴瘤等方面有显著疗效,但也存在复发率高、治疗后实体瘤适应症有限的局限性。在中国的十种临床细胞免疫治疗产品中,只有两种用于治疗实体瘤,而七种用于治疗血液系统癌症。
同时,从研发竞争来看,目前细胞免疫治疗主要集中在CD19靶向和CAR-T领域,这可能会造成冗余和未来过度的市场竞争根据上述“自然评论药物发现”报告,目前世界上有142种针对CD19的治疗方法,占总数的14%,其中130种为CAR-T疗法;中国也不例外。10种临床产品中有9种是CAR-T细胞产品,其中一半是CD19靶。如果细胞免疫疗法要在未来取得更大的突破,就必须在其他目标和领域做出努力。
此外,价格也可能是一大痛点。提到分别高达475,000美元和373,000美元的凯姆瑞亚和耶斯卡塔,高昂的价格可能让许多患者望而却步。所有这些因素都会影响细胞免疫治疗的临床应用和市场空间。
监管标准尚未逐步统一。对于资本而言,吸引其进入细胞免疫治疗行业的驱动力不仅是可以预期的市场空间,而且是趋于标准化的行业监管。
事实上,虽然细胞免疫疗法在中国并不是什么新鲜事,在中国也有大约20年的经验,但长期以来一直是法律法规的盲点,这在很大程度上阻碍了该行业的规范化发展和应用。三年前引起关注的“魏则西事件”是监管不力的典型表现。
2年4月,xi大学二年级学生魏泽喜被诊断为晚期滑膜肉瘤。通过医生,魏泽西和他的父母通过百度在头版找到了武警总队第二医院。他们用“斯坦福技术和20年的保护”在四种所谓的免疫疗法上花了20多万元2016年4月,魏泽西死于病情恶化。除了揭露百度医药广告竞价排名的罪恶和莆田医院的混乱之外,细胞免疫疗法也被放在了前列。
2年5月,国家卫生和计划委员会要求医疗机构紧急停止细胞免疫疗法的临床应用,允许它们只进行临床研究,不进行收费治疗。同年12月,国家食品药品监督管理局发布了《细胞产品研究和评价技术指南》,首次明确提出将细胞免疫治疗产品纳入药品监管范围。2017年底,CFDA正式发布了《细胞免疫治疗产品及评价技术指南》,限定了适用的细胞治疗产品范围,规定了细胞免疫治疗产品的药学研究、非临床研究和临床研究。业内人士认为,这基本上确认了细胞免疫治疗产品的药物监管路径,行业已逐步进入从生产到收集的产品转移的标准化轨道。尽管如此,关于细胞免疫疗法的争论和争论从未停止过。据公开信息显示,仅2017年一年,中国就有两起接受免疫治疗的患者死亡案例,涉及徐州医科大学附属医院和苏州柏桐生物技术有限公司。前者也于2018年6月被患者家属起诉,这被媒体称为中国首例CAR-T疗法诉讼,再次反映了细胞免疫治疗领域的混乱。
难以统一监管和标准被视为这个问题的根源2018年,国家卫生委员会宣布将支持细胞免疫疗法在医疗机构的临床应用。今年3月底,经国家食品药品监督管理局批准,国家卫生安全委员会发布了《体细胞疗法临床研究和转化应用管理办法》,旨在规范和促进体细胞疗法临床研究和转化应用,意味着医疗机构开展细胞疗法临床研究和开展收费治疗的大门有望重新打开。
但根据管理办法,医疗机构可以在备案后开展临床研究,转换和申请可以收取费用,三级医院仅限于执行和其他规定,这导致业界的不同批评,特别是医疗机构的监管标准相对宽松,这导致很多企业不满,需要按照药品监管路径花费更高的成本。目前,该管理办法尚未正式颁布实施
表明目前对细胞免疫治疗的调控和标准还没有统一的共识。细胞免疫疗法的双重性质导致了不同的定义,这反过来又决定了应用和调控机构之间的差异如果它被定义为一种药品,它应该由药品公司主导,并由药品管理部门监督。如果它被定义为诊断和治疗,它应该由医院领导和卫生部门监督。显然,细胞免疫疗法的本质仍处于摇摆状态,政策的平衡也在来回摇摆。
但从目前的政策趋势来看,细胞免疫治疗行业将形成药企和医院共同牵头、国家食品药品监督管理局和卫生安全委员会监管的双轨监管模式。这引起了关注。复星凯特生物技术有限公司CEO王立群此前曾公开表示,“双轨制监管可能导致行业质量标准和临床研究标准混淆,影响行业规范健康发展。”他认为,对于病人来说,只有在严格的监督下,临床的安全性和有效性才能得到保证
然而,业内也有人认为双轨监管并不可怕。关键是要把药品分为药品监管部门和医疗卫生部门,但监管标准必须统一。目前,统一监管的可能性不大,但统一标准可能还需要一段时间。