< p >站在2020年的起点,回顾2019年,制药行业可谓跌宕起伏。对于早期创新转型的企业来说,早期布局的优势已经逐渐显现出来。
来自魔方的统计数据显示,截至12月28日,美国食品和药物管理局已批准48种新药(包括新的分子实体和新的生物产品),略低于2018年的59种。欧洲药品管理局已经批准了37种新药(包括新的活性物质,不包括仿制药和生物类似物),比2018年的64种有所下降。中国NMPA已批准48种新药(包括化学品1类和5.1类、生物制品1类和2类、中药和疫苗),略低于2018年的53种
根据企业维度的统计,诺华(NVS。美国)是2019年创新药物批准的最大赢家,共获得10项批准。第二个是葛兰素史克。美国)、辉瑞(PFE。美国)和强生公司(JNJ)。美国),有6个新药批准。LLY。美国,上图和AZN。美国各有4个项目,而中共十三大、拜耳和蔡威各有3个项目。2019年,这10家企业在欧洲、美国和中国监管市场批准的新药数量位列前10名。
2018年,诺华公司仅从美国食品和药物管理局获得了一种新药,但今年收获颇丰,从美国食品和药物管理局获得了六种新药,在美国食品和药物管理局批准的名单上排名第一包括:
- Egaten(三氯苯达唑)用于治疗6岁以上的肝片吸虫病患者;
- Mayzent (siponimod)用于治疗成人复发性多发性硬化症;
-Piqray(alpelib)用于绝经后女性乳腺癌患者PI3K α突变的HR+ HER2-联合氟伐沙平治疗后的疾病进展;
-基因治疗产品Zolgensma
用于治疗2岁以下患有脊髓性肌营养不良症的患者,该患者携带编码运动神经元存活蛋白(SMN)的两个SMN1等位基因的突变 199on asemongene abeparovac-xioi);-用于湿性年龄相关性黄斑变性的单克隆抗体Beovu (brolucizumab );
-单克隆抗体adakvo(crizanzumab-tmca)
用于降低16岁以上镰状细胞性贫血患者血管闭塞危象的发生率 2019年诺华批准的
新药
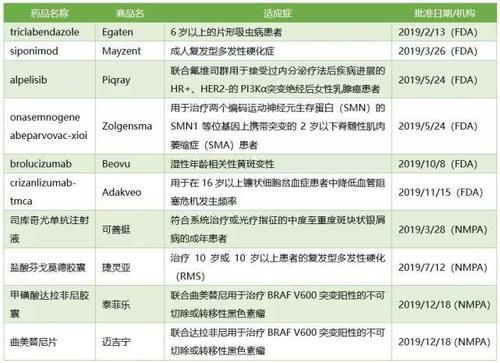
除了是美国食品和药物管理局的顶级药物外,诺华公司2019年在中国批准的新药是首屈一指的。包括用于治疗银屑病的白介素-17A单克隆抗体四库其昔单抗注射液、用于治疗多发性硬化的盐酸芬戈莫德胶囊、用于治疗BRAF V600突变阳性的不可切除或转移性黑色素瘤的甲磺酸达拉非替尼胶囊和曲美替尼片
事实上,诺华不仅在2019年收获了中国最多的新品种,而且还是医疗保险谈判的最大赢家。缬沙坦钠片、注射用奥玛单抗、雷珠单抗注射液等7个品种通过协商进入国家医疗保险。阿特拉帕乙醇胺片、立明透皮贴剂、二甲双胍维格列汀片和0.5%盐酸莫西沙星滴眼液等4个品种通过常规途径进入医疗保险目录。
鉴于NMPA加快批准新药审查,诺华公司全球药品开发主管兼首席医疗官蔡崇信博士也公开表示,诺华公司计划在2023年之前在中国提交50份新药申请。
早些时候,评估制药公司的报告预测,到2024年,诺华将超过辉瑞和罗氏,成为世界上最大的处方药公司,收入为532亿美元。根据这种新药的申请和批准速度,诺华将很快回到行业的顶端。
医疗代表与您共成长!